TEMAS
- Introducción a la Química Orgánica : Conceptos previos y Análisis
Químicos.
Químicos.
- Compuestos Orgánicos : Clasificación y Nomenclatura.
Reacciones Orgánicas.
Reacciones Orgánicas.
- Hidrocarburos : Alifáticos y Cíclicos.
Introducción a la Química Orgánica
Conceptos previos:
La ciencia química surge antes del siglo XVII a partir de los estudios de alquimia, populares entre muchos de los científicos de la época. Se considera que los principios básicos de la química se recogen por primera vez en la obra del científico británico Robert Boyle: The Sceptical Chymist (1661). La química como tal comienza sus andares un siglo más tarde con los trabajos de Antoine Lavoisier que junto a Carl Wilhelm Scheele descubrieron el oxígeno, Lavoisier a su vez propuso la ley de conservación de masa y la refutación de la teoría del flogisto como teoría de la combustión.
La Química Orgánica o Química del carbono es la rama de la química que estudia una clase numerosa de moléculas que contienen carbono formando enlaces covalentes carbono-carbono o carbono-hidrógeno, también conocidos como compuestos orgánicos. Friedrich Wöhler y Archibald Scott Couper son conocidos como los "padres" de la química orgánica.
== Cronología ==
- 1675: Lémerg clasifica los productos químicos naturales, según su origen en minerales, vegetales y animales
- 1784: Antoine Lavoisier demuestra que todos los productos vegetales y animales están formados básicamente por carbono e hidrógeno y, en menor proporción, nitrógeno, oxígeno y azufre
- 1807: Jöns Jacob Berzelius clasifica los productos químicos en:
- Orgánicos: los que proceden de organismos vivos.
- Inorgánicos: los que proceden de la matéria inanimada.
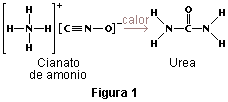
- 1828: Friedrich Wöhler sintetiza a partir de sustancias inorgánicas y con técnicas normales de laboratorio la sustáncia Urea, la segunda sustancia orgánica obtenida artificialmente, luego del oxalato de amonio.
Existe una amplia gama de sustancias (medicamentos, vitaminas, plásticos, fibras sintéticas y naturales, hidratos de carbono, proteínas y grasas) formadas por moléculas orgánicas.
Los químicos orgánicos determinan la estructura de las moléculas orgánicas, estudian sus reacciones y desarrollan procedimientos para sintetizar compuestos orgánicos.
Esta rama de la química ha afectado profundamente la vida desde el siglo XX: ha perfeccionado los materiales naturales y ha sintetizado sustancias naturales y artificiales que, a su vez, han mejorado la salud, han aumentado el bienestar y han favorecido la utilidad de casi todos los productos actuales.
Materiales orgánicos son todos aquellos que poseen en su estructura química el elemento carbono, por lo tanto entran en su categoría todos los seres vivos, los hidrocarburos, y en especial el petróleo y sus derivados, etc.
La aparición de la química orgánica se asocia a menudo al descubrimiento, en 1828, por el químico alemán Friedrich Wöhler, de que la sustancia inorgánica cianato de amonio podía convertirse en urea, una sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos creían que para sintetizar sustancias orgánicas era necesaria la intervención de lo que llamaban 'la fuerza vital' es decir, los organismos vivos.
Importancia de la química orgánica
El experimento de Wöhler rompió la barrera entre sustancias orgánicas e inorgánicas. Los químicos modernos consideran compuestos orgánicos a aquellos que contienen carbono y otros elementos (que pueden ser uno o más), siendo los más comunes: hidrógeno, oxígeno, nitrógeno, azufre y los halógenos. En la actualidad, a la química orgánica se la llama también química del carbono.
A pesar de su aparición tardía en la historia de la química, la química de los compuestos del carbono es en la actualidad la rama de las ciencias químicas que crece con mayor rapidez. La variedad de productos derivados del carbono puede resultar prácticamente ilimitada debido a las propiedades singulares de dicho átomo y, por tanto, constituye una fuente potencial de nuevos materiales con propiedades especiales, de medicamentos y productos sanitarios, de colorantes, de combustibles, etc.
Algunos de estos ejemplos son considerados a continuación.
La materia viviente es, en parte, materia constituida por derivados del carbono. Las transformaciones que sufren los seres vivos, y que observamos a simple vista, se corresponden, desde un punto de vista submicroscópico o molecular, con cambios o reacciones químicas de las sustancias biológicas. Azúcares, grasas, proteínas, hormonas, ácidos nucleicos, son algunos ejemplos de sustancias, todas ellas compuestos del carbono, de cuya síntesis y degradación en el interior de los organismos vivos se ocupa la bioquímica.
Diferencias entre compuestos orgánicos e inorgánicos
Entre las diferencias más importantes se encuentran:
-Todos los compuestos orgánicos utilizan como base de construcción al átomo de carbono y unos pocos elementos más, mientras que en los compuestos inorgánicos participan a la gran mayoría de los elementos conocidos.
-En su origen los compuestos inorgánicos se forman ordinariamente por la acción de las fuerzas fisicoquímicas: fusión, sublimación, difusión, electrolisis y reacciones químicas a diversas temperaturas. La energía solar, el oxígeno, el agua y el silicio han sido los principales agentes en la formación de estas sustancias.
-Las sustancias orgánicas se forman naturalmente en los vegetales y animales pero principalmente en los primeros, mediante la acción de los rayos ultravioleta durante el proceso de la fotosíntesis: el gas carbónico y el oxígeno tomados de la atmósfera y el agua, el amoníaco, los nitratos, los nitritos y fosfatos absorbidos del suelo se transforman en azúcares, alcoholes, ácidos, ésteres, grasas, aminoácidos, proteínas, etc., que luego por reacciones de combinación, hidrólisis y polimerización entre otras, dan lugar a estructuras más complicadas y variadas.
-La totalidad de los compuestos orgánicos están formados por enlace covalentes, mientras que los inorgánicos lo hacen mediante enlaces iónicos y covalentes.
-La mayoría de los compuesto orgánicos presentan isómeros (sustancias que poseen la misma fórmula molecular pero difieren en sus propiedades físicas y químicas); los inorgánicos generalmente no presentan isómeros.
-Los compuestos orgánicos encontrados en la naturaleza, tienen origen vegetal o animal, muy pocos son de origen mineral; un buen número de los compuestos inorgánicos son encontrados en la naturaleza en forma de sales, óxidos, etc.
-Los compuestos orgánicos forman cadenas o uniones del carbono consigo mismo y otros elementos; los compuestos inorgánicos con excepción de algunos silicatos no forman cadenas.
-El número de los compuestos orgánicos es muy grande comparado con el de los compuestos inorgánicos.
Grupos Funcionales
Hibridación del carbono
"OJO" Ir al enlace: HIBRIDACIÓN
En química, se habla de hibridación cuando en un átomo se mezclan varios orbitales atómicos para formar nuevos orbitales híbridos. Los orbitales híbridos explican la forma en que se disponen los electrones en la formación de los enlaces, dentro de la teoría del enlace de valencia, y justifican la geometría las moléculas.
Orbitales
Los electrones de un átomo tienen la tendencia de ubicarse en orbitales específicos alrededor del núcleo, lo cual se enuncia en la ecuación de Schrödinger. Los detalles sobre número y orientación de electrones en cada orbital depende de las propiedades energéticas descritas por los números cuánticos. El primer orbital, el más cercano al núcleo es el llamado 1s y solo puede ser ocupado por dos electrones. Un átomo con un solo electrón (hidrógeno) y uno con dos electrones (helio) ubican su(s) electrón(es) en este orbital.
Un átomo con 3 (litio) y cuatro (berilio) electrones tendrá que ubicar el tercer y cuarto electrón en el siguiente orbital, llamado 2s, el cual también solo acepta dos electrones.
Hibridación sp³ (cuatro orbitales sp³)
El átomo numérico de carbono tiene seis electrones: dos se ubican en el orbital 1s (1s²), dos en el 2s (2s²) y los restantes dos en el orbital 2p (2p²). Debido a su orientación en el plano tridimensional el orbital 2p tiene capacidad para ubicar 6 electrones: 2 en el eje de las x, dos en el eje de las y y dos electrones en el eje de las z. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón):

Para satisfacer su estado energético inestable, un átomo de valencia como el del carbono, con orbitales parcialmente llenos (2px y 2py necesitarían tener dos electrones) tiende a formar enlaces con otros átomos que tengan electrones disponibles. Para ello, no basta simplemente colocar un electrón en cada orbital necesitado. En la naturaleza, éste tipo de átomos redistribuyen sus electrones formando orbitales híbridos. En el caso del carbono, uno de los electrones del orbital 2s es extraido y se ubica en el orbital 2pz. Así, los cuatro últimos orbitales tienen un electrón cada uno:

El estímulo para excitar al electrón del 2s al 2pz es aportado por el primer electrón en formar enlace con un átomo con este tipo de valencia. Por ejemplo, el hidrógeno en el caso del metano. Esto a su vez incrementa la necesidad de llenado de los restantes orbitales. Estos nuevos orbitales híbridos dejan de ser llamados 2s y 2p y son ahora llamados sp3 (un poco de ambos orbitales):

De los cuatro orbitales así formados, uno (25%) es proveniente del orbital s (el 2s) del carbono y tres (75%) provenientes de los orbitales p (2p). Sin embargo todos se sobreponen al aportar la hibridación producto del enlace. Tridimensionalmente, la distancia entre un hidrógeno y el otro en el metano son equivalentes e iguales a un ángulo de 109°.
Hibridación sp²
Se define como la combinacion de un orbital S y 2 P, para formar 3 orbitales híbridos, que se disponen en un plano formando ángulos de 120º.
Los átomos que forman hibridaciones sp2 pueden formar compuestos con enlaces dobles. Forman un ángulo de 120º y su molécula es de forma plana. A los enlaces simples se les conoce como enlaces sigma (σ) y los enlaces dobles están compuestos por un enlace sigma y un enlace pi (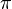 ). Las reglas de ubicación de los electrones en estos casos, como el alqueno etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla sólo con dos de los orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
). Las reglas de ubicación de los electrones en estos casos, como el alqueno etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla sólo con dos de los orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
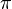 ). Las reglas de ubicación de los electrones en estos casos, como el alqueno etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla sólo con dos de los orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
). Las reglas de ubicación de los electrones en estos casos, como el alqueno etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla sólo con dos de los orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes
Tridimensionalmente, la distancia entre un hidrógeno y otro en algún carbono del etileno son equivalentes e iguales a un ángulo de 120°.
Hibridación sp
Se define como la combinacion de un orbital S y un P, para formar 2 orbitales híbridos, con orientacion lineal. Este es el tipo de enlace híbrido, con un ángulo de 180º y que se encuentra existente en compuestos con triples enlaces como los alquinos (por ejemplo el acetileno):

se caracteriza por la presencia de 2 orbitales pi(π).
Análisis Químico:
La Química Analítica puede definirse como la ciencia que desarrolla y mejora métodos e instrumentos para obtener información sobre la composición y naturaleza química de la materia. Dentro de la Química Analítica se incluye el Análisis Químico que es la parte práctica que aplica los métodos de análisis para resolver problemas relativos a la composición y naturaleza química de la materia.
La Química Analítica puede definirse como la ciencia que desarrolla y mejora métodos e instrumentos para obtener información sobre la composición y naturaleza química de la materia. Dentro de la Química Analítica se incluye el Análisis Químico que es la parte práctica que aplica los métodos de análisis para resolver problemas relativos a la composición y naturaleza química de la materia.
Es interesante realizar una definición de términos ligados al análisis:
* Muestra: Parte representativa de la materia objeto del análisis.
* Analito: Especie química que se analiza.
* Técnica: Medio de obtener información sobre el analito.
* Método: Conjunto de operaciones y técnicas aplicadas al análisis de una muestra.
* Análisis: Estudio de una muestra para determinar su composición o su naturaleza química.
Dentro de la Química Analítica también pueden diferenciarse diversas áreas según la información que se desea obtener. Así, la Química Analítica Cualitativa se centra en identificar la presencia o ausencia de un analito, mientras que la Química Analítica Cuantitativa desarrolla métodos para determinar su concentración.
.. Análisis Orgánico
El análisis orgánico pretende la completa caracterización e identificación de la estructura molecular de un compuesto orgánico. En una identificación sistemática se pueden establecer varias etapas:
1-Examen superficial o “análisis organoléptico”: consiste en establecer las características físicas de la muestra y su detallada descripción. Incluye estado físico, color, olor, solubilidad, etc.
2-Purificación o “análisis inmediato”: pretende establecer el grado de pureza del compuesto y los métodos de purificación. La necesidad de purificación de un compuesto en una mezcla vendrá indicada por el intervalo del punto de fusión, el punto de ebullición, del comportamiento en cromatografía de capa fina o de gases, o de cualquier heterogeneidad en el aspecto general o del color, etc.
3- Análisis elemental cualitativo: Consiste en la detección de los elementos químicos presentes en el compuesto puro. Por lo tanto, se debe establecer la presencia de los elementos carbono, hidrógeno, oxígeno, nitrógeno, azufre, fósforo, halógenos, etc., como los más comunes en las estructuras moleculares orgánicas. Algunos compuestos orgánicos son inflamables o algunos se queman con facilidad o se carbonizan, indicando con ello la presencia de carbono. Sin embargo, algunos no son inflamables, o cuando arden lo hacen con llama no fuliginosa, no producen humo, o no se carbonizan. Para estos casos se aconseja realizar una detección de C e H mas precisa. Esto se consigue en forma categórica calentando lamuestra con CuO en un tubo de ensayo seco y reconociendo el C y el H bajo forma de CO2 y H2O, productos de la reacción:
Muestra orgánica + CuO + calor → CO2 + H2O(l) + Cu
Los elementos N, S, P y Halógenos no se pueden analizar directamente puesto que los átomos de esos elementos normalmente se encuentran enlazados covalentemente.
4- Análisis Elemental Cuantitativo:
En química se conoce como análisis cuantitativo a la determinación de la abundancia absoluta o relativa (muchas veces expresada como concentración) de una, varias o todas las sustancias químicas presentes en una muestra.Los métodos y técnicas de análisis cuantitativo pueden clasificarse en:
- Gravimétricos: Cuantifican la masa de la sustancia a analizar (analito) o de algún compuesto químicamente relacionado con él. Un ejemplo es la argentometría
- Volumétricos: Cuantifican el volumen de una disolución de una sustancia químicamente equivalente al analito. Un ejemplo es la valoración ácido-base o la valoración redox.
- Ópticos: Espectroscópicos y no-espectroscópicos: Cuantifican la interacción entre la radiación electromagnética con el analito o las radiaciones que emanan del mismo.[3] Se pueden estudiar los espectros de absorción (como en la espectroscopia de resonancia magnética nuclear o en la espectrofotometría ultravioleta-visible), los espectros de emisión (como en la espectrofluorimetría) y los espectros Raman (en la espectroscopia Raman), u otras propiedades ópticas (como en la refractometría o la polarografía).
- Electroanalíticos: Cuantifican ciertas magnitudes eléctricas relacionadas con la cantidad de analito. Algunos ejemplos son la potenciometría, culombimetría y la electrogravimetría.
Métodos e Instrumentos:
La espectroscopia o estudio de las interacciones de la radiación electromagnética con la materia, es el mayor y más exacto grupo de métodos instrumentales utilizados en los análisis químicos y en toda la ciencia química. El espectro electromagnético se divide en la siguiente gama de longitudes de onda: rayos gamma, rayos X, ultravioletas, visibles, infrarrojos, microondas y ondas radioeléctricas. Las interacciones electromagnéticas con la materia provocan la absorción o emisión de energía a través de la transición de los electrones entre niveles cuánticos o discretos de energía, vibraciones de enlaces, rotaciones moleculares y transición de electrones entre orbitales de átomos y moléculas. Todas estas interacciones tienen lugar en instrumentos denominados espectrómetros, espectrofotómetros o espectroscopios. Los espectros generados en esos equipos se graban gráfica o fotográficamente en espectrogramas o espectrógrafos, que permiten el estudio de la longitud de onda y la intensidad de la radiación absorbida o emitida por la muestra analizada.
La espectrofotometría de absorción de infrarrojos es adecuada para análisis orgánicos, pues los enlaces en alquenos, ésteres, alcoholes y otros grupos funcionales tienen fuerzas muy diferentes y absorben la radiación de infrarrojos en una gran variedad de frecuencias o energías. Esta absorción se refleja en el espectrógrafo en forma de picos.
La espectroscopia por resonancia magnética nuclear (RMN) depende de la transición entre estados de energía de rotación nuclear por absorción de energía de radiofrecuencia electromagnética. Por ejemplo, en el espectro de RMN del hidrógeno, los diferentes estados químicos del hidrógeno absorben radiación electromagnética a distintas energías. Así, los grupos orgánicos -CH3 y -CH2Cl dan picos muy diferentes y con una excelente resolución. Por todo ello, los espectros de RMN son una herramienta insustituible en el análisis cualitativo para determinar la estructura de las moléculas orgánicas.
PROBLEMA: Calcular la cantidad en gramos de Hidrógeno, Carbono y Oxígeno presente en una muestra de 1.0 g de materia orgánica si al calentarla en un aparato de Dumas se encuentra que el aumento del peso del primer tubo fue de 1,287 g y que el aumento del peso del segundo tubo fue de 2,108 g. Procedemos
entonces de la siguiente manera:

Aparato de Dumas.
.. Síntesis Orgánica:
Ejemplo de determinación de la Fórmula Empirica y Molecular de un compuesto dado.
COMPUESTOS ORGÁNICOS
ISOMERÍA
La importancia fundamental de la estructura molecular es ilustrada a través del concepto de Isomería.
En los compuestos orgánicos, la capacidad del átomo de carbono para formar enlaces sencillos y múltiples consigo mismo y con otros átomos conduce a diversas estructuras para moléculas de igual fórmula molecular. A estas estructuras se les denomina isómeros, del griego isos = igual y meros = parte.
Una clase de isómeros son los isómeros estructurales (o constitucionales), los cuales difieren entre sí por la secuencia de enlace de sus átomos en la molécula y en sus propiedades físicas y químicas. Se subdividen en:
a. Isómeros de Cadena, en los cuales las cadenas alquílicas (hidrocarbonadas) se ramifican en modo diferente.
b. Isómeros de Posición, los cuales difieren en la ubicación de una función química en la cadena hidrocarbonada.
c. Isómeros de Función, los cuales pertenecen a familias diferentes porque sus grupos funcionales son distintos, sin embargo tienen la misma fórmula molecular.
Es de esperar que el número de isómeros estructurales potenciales se incremente a medida que aumenta el número de átomos de carbono en la cadena hidrocarbonada. Por ejemplo en la familia de los alcanos existen dos compuestos con fórmula  , seis con la formula
, seis con la formula , , setenta y cinco con
, , setenta y cinco con  etc.
etc.
 , seis con la formula
, seis con la formula , , setenta y cinco con
, , setenta y cinco con  etc.
etc.
Finalmente existe otro nivel de isomería más sutil donde las moléculas con la misma fórmula molecular tienen sus átomos o grupos unidos en el mismo orden, pero difieren solamente en el arreglo espacial. A estas moléculas isoméricas se les denomina Este reoisómeros y su estudio constituye una rama de la química conocida como Estereoquímica (del griego stereos = sólido) que estudia la estructura molecular en tres dimensiones. (Ver Capítulo 6)
Hidrocarburos: Clasificación:
El término hidrocarburo se refiere a compuestos formados exclusivamente por átomos de carbono e hidrógeno a través de enlaces covalentes. Con base en su estructura, los hidrocarburos se dividen en dos clases principales: Alifáticos y Aromáticos. Los primeros subdividen en familias:
Alcanos, Alquenos, Alquinos y sus análogos Cíclicos, también denominados Alicíclicos.
Los hidrocarburos alifáticos en general están formados por cadenas abiertas de átomos de carbono (alcanos, alquenos o alquinos), o por estructuras cíclicas (hidrocarburos alicíclicos).
Originalmente muchos de los primeros hidrocarburos alifáticos que se estudiaron se obtuvieron a partir de ácidos grasos, por lo tanto se les asignó el nombre de alifáticos (del griego aleiphatos = grasa).
 .
.
También los llamados ciclo alcanos (Tabla 2.4) de fórmula general son hidrocarburos saturados que constituyen una serie homóloga. El ciclopropano es el cicloalcano más sencillo, posee tres carbonos y su estructura es triangular, con enlaces ligeramente doblados.
son hidrocarburos saturados que constituyen una serie homóloga. El ciclopropano es el cicloalcano más sencillo, posee tres carbonos y su estructura es triangular, con enlaces ligeramente doblados.
 son hidrocarburos saturados que constituyen una serie homóloga. El ciclopropano es el cicloalcano más sencillo, posee tres carbonos y su estructura es triangular, con enlaces ligeramente doblados.
son hidrocarburos saturados que constituyen una serie homóloga. El ciclopropano es el cicloalcano más sencillo, posee tres carbonos y su estructura es triangular, con enlaces ligeramente doblados.
Isomería
Ejemplo 3 Nombre correctamente el compuesto:






































































































































































































No hay comentarios:
Publicar un comentario